- SULFURIQUE (ACIDE)
- SULFURIQUE (ACIDE)Déjà connu il y a huit cents ans sous le nom d’«esprit de vitriol», l’acide sulfurique est essentiellement un produit de l’industrie. Toutefois, sa présence est signalée dans certains torrents volcaniques de l’Amérique du Sud. Dans les sols, l’oxydation du soufre en acide est très lente à l’air humide, mais elle est favorisée par la lumière solaire et une température de 40 0C.L’acide sulfurique (formule H2S4) est utilisé dans de si nombreuses industries chimiques que sa préparation peut être considérée comme l’industrie de base de la chimie minérale et qu’il n’est guère possible de dénombrer tous ses emplois. Sa production dépassait déjà 10 Mt (millions de tonnes) au début de ce siècle, atteignait 38 Mt en 1955 et 160 en 1990. En 1990, la France en a produit 4 Mt.La fabrication des engrais, superphosphates et sulfate d’ammonium, est le premier consommateur, avec une demande voisine du tiers de la production. Ce principal emploi n’est pas près de connaître un ralentissement compte tenu des immenses besoins qui restent à satisfaire dans ce domaine. L’industrie chimique l’utilise en chimie minérale, synthèse organique, produits fluorés. On peut également citer l’industrie des pigments minéraux; l’industrie du pétrole l’utilise pour le raffinage. Enfin, parmi les activités les plus diverses utilisant l’acide sulfurique, citons les industries textiles et alimentaires, le décapage métallurgique, la préparation des détergents et celle des explosifs.PropriétésL’acide sulfurique anhydre, liquide incolore, inodore et visqueux, de poids spécifique 1,83 à + 15 0C, se solidifie à + 10,35 0C et forme plusieurs hydrates de formule générale H2S4, n H2O (n = 1, 2, 3, 4, 6). La température de solidification varie de façon importante avec le degré d’hydratation.L’addition d’eau à l’acide sulfurique produit un dégagement de chaleur considérable, en même temps qu’une contraction du volume total. Mis en contact avec la peau, l’acide pur occasionne de sérieuses brûlures. En conséquence, il faut avoir soin de verser lentement l’acide dans l’eau; l’opération inverse provoque une réaction extrêmement violente avec projection d’acide.La concentration de l’acide obtenu par dilution est indiquée en pourcentage de H2S4 ou en degrés Baumé. Le degré Baumé français est défini par la formule:
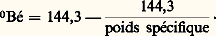 Certains pays utilisent une constante légèrement différente. L’acide concentré correspond aux acides de 65 à 66 degrés Baumé, avec 92 à 96 p. 100 de H2S4.L’acide sulfurique est un agent déshydratant efficace; très avide d’eau, il fixe l’humidité de l’air.Le point d’ébullition de l’acide dilué évolue avec la concentration. La distillation tend à amener le liquide à la composition de 98,3 p. 100 de H2S4 pour laquelle la température d’ébullition est la plus élevée (330 0C environ sous 750 mm de Hg). L’acide gazeux est alors partiellement dissocié en S3 et H2O.L’acide sulfurique absolu (100 p. 100) dissout S3. Les solutions obtenues sont appelées oléums ou acides fumants (en raison de la tension de vapeur de SO3). Ces produits sont vendus avec l’indication du pourcentage en S3 dissous dans H2S4 anhydre. Introduit en légère proportion, l’anhydride donne naissance à l’acide pyrosulfurique ou disulfurique H2S27:
Certains pays utilisent une constante légèrement différente. L’acide concentré correspond aux acides de 65 à 66 degrés Baumé, avec 92 à 96 p. 100 de H2S4.L’acide sulfurique est un agent déshydratant efficace; très avide d’eau, il fixe l’humidité de l’air.Le point d’ébullition de l’acide dilué évolue avec la concentration. La distillation tend à amener le liquide à la composition de 98,3 p. 100 de H2S4 pour laquelle la température d’ébullition est la plus élevée (330 0C environ sous 750 mm de Hg). L’acide gazeux est alors partiellement dissocié en S3 et H2O.L’acide sulfurique absolu (100 p. 100) dissout S3. Les solutions obtenues sont appelées oléums ou acides fumants (en raison de la tension de vapeur de SO3). Ces produits sont vendus avec l’indication du pourcentage en S3 dissous dans H2S4 anhydre. Introduit en légère proportion, l’anhydride donne naissance à l’acide pyrosulfurique ou disulfurique H2S27: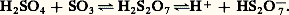 Les oléums plus concentrés contiennent des acides polysulfuriques H2O(SO3)n dont seuls les termes H2S310 et H2S413 sont bien connus.La conductivité présentée par l’acide absolu résulte d’une auto-ionisation de la molécule H2S4:
Les oléums plus concentrés contiennent des acides polysulfuriques H2O(SO3)n dont seuls les termes H2S310 et H2S413 sont bien connus.La conductivité présentée par l’acide absolu résulte d’une auto-ionisation de la molécule H2S4: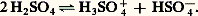 Dans les solutions aqueuses diluées, la première ionisation de l’acide est complète:
Dans les solutions aqueuses diluées, la première ionisation de l’acide est complète: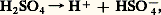 mais l’ion bisulfate HS4- est un acide assez faible:
mais l’ion bisulfate HS4- est un acide assez faible: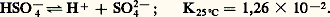 La tendance de l’acide sulfurique à fournir de l’oxygène au cours de sa décomposition par la chaleur en fait un oxydant d’autant plus actif qu’il est concentré. C’est ainsi que presque toutes les matières organiques sont détruites par l’acide bouillant. Les non-métaux sont aisément oxydables; le soufre, le sélénium, le tellure, le phosphore, l’arsenic et le carbone sont oxydés par l’acide sulfurique chaud et concentré avec formation de gaz sulfureux. Quant aux métaux, ils sont tous attaqués, sauf l’or. Le plomb résiste à l’acide sulfurique jusqu’à 95 p. 100 de H2S4 à température ambiante, 80 p. 100 de H2S4 à 140 0C. Le fer est facilement dissous par l’acide étendu, mais l’attaque se ralentit lorsque la concentration de l’acide augmente. L’acier est utilisable pour le stockage et la manipulation des acides de plus de 65 p. 100 et des oléums aux basses températures; à des températures plus élevées, l’acier peut être protégé par une couche de matériaux réfractaires (quartz, porcelaine, céramique, ciments et pierres antiacides).La réaction de caractérisation essentielle de l’acide sulfurique est celle que présentent les ions S42- avec les ions Ba2+ pour former du sulfate de baryum insoluble dans l’eau et les acides.Fabrication industrielleLa fabrication de l’acide sulfurique utilise le procédé aux oxydes d’azote (procédé par chambres et par tours) ou le procédé de contact. Elle comprend deux phases successives:– la préparation et l’épuration d’un mélange d’air et d’anhydride sulfureux S2;– l’oxydation de S2 en S3 à l’aide de vapeurs nitreuses ou de catalyseurs solides.Préparation de l’anhydride sulfureuxLes matières premières principales sont aujourd’hui le soufre et les minerais sulfurés.Souvent très pur et facilement purifiable, le soufre élémentaire est la matière de départ la plus simple. Il est extrait pour l’essentiel du golfe du Mexique par le procédé Frasch [cf. SOUFRE]. De ce fait, l’industrie américaine de l’acide sulfurique repose sur le soufre. On le récupère aussi de certains gaz naturels qui contiennent de l’hydrogène sulfuré H2S. Le gisement de Lacq produit environ 1,5 Mt de soufre par an. La qualité du soufre et le mode de transformation ultérieure du gaz sulfureux décident du choix entre les différentes formes de fours. L’oxydation du soufre brut solide par l’air est réalisée dans des fours rotatifs qui permettent l’évacuation des résidus non volatils. Le soufre liquide, purifié par sédimentation et filtration, est pulvérisé et brûlé à l’état de fine dispersion. La combustion à 1 100 0C dégage une chaleur élevée utilisable pour la production de vapeur:
La tendance de l’acide sulfurique à fournir de l’oxygène au cours de sa décomposition par la chaleur en fait un oxydant d’autant plus actif qu’il est concentré. C’est ainsi que presque toutes les matières organiques sont détruites par l’acide bouillant. Les non-métaux sont aisément oxydables; le soufre, le sélénium, le tellure, le phosphore, l’arsenic et le carbone sont oxydés par l’acide sulfurique chaud et concentré avec formation de gaz sulfureux. Quant aux métaux, ils sont tous attaqués, sauf l’or. Le plomb résiste à l’acide sulfurique jusqu’à 95 p. 100 de H2S4 à température ambiante, 80 p. 100 de H2S4 à 140 0C. Le fer est facilement dissous par l’acide étendu, mais l’attaque se ralentit lorsque la concentration de l’acide augmente. L’acier est utilisable pour le stockage et la manipulation des acides de plus de 65 p. 100 et des oléums aux basses températures; à des températures plus élevées, l’acier peut être protégé par une couche de matériaux réfractaires (quartz, porcelaine, céramique, ciments et pierres antiacides).La réaction de caractérisation essentielle de l’acide sulfurique est celle que présentent les ions S42- avec les ions Ba2+ pour former du sulfate de baryum insoluble dans l’eau et les acides.Fabrication industrielleLa fabrication de l’acide sulfurique utilise le procédé aux oxydes d’azote (procédé par chambres et par tours) ou le procédé de contact. Elle comprend deux phases successives:– la préparation et l’épuration d’un mélange d’air et d’anhydride sulfureux S2;– l’oxydation de S2 en S3 à l’aide de vapeurs nitreuses ou de catalyseurs solides.Préparation de l’anhydride sulfureuxLes matières premières principales sont aujourd’hui le soufre et les minerais sulfurés.Souvent très pur et facilement purifiable, le soufre élémentaire est la matière de départ la plus simple. Il est extrait pour l’essentiel du golfe du Mexique par le procédé Frasch [cf. SOUFRE]. De ce fait, l’industrie américaine de l’acide sulfurique repose sur le soufre. On le récupère aussi de certains gaz naturels qui contiennent de l’hydrogène sulfuré H2S. Le gisement de Lacq produit environ 1,5 Mt de soufre par an. La qualité du soufre et le mode de transformation ultérieure du gaz sulfureux décident du choix entre les différentes formes de fours. L’oxydation du soufre brut solide par l’air est réalisée dans des fours rotatifs qui permettent l’évacuation des résidus non volatils. Le soufre liquide, purifié par sédimentation et filtration, est pulvérisé et brûlé à l’état de fine dispersion. La combustion à 1 100 0C dégage une chaleur élevée utilisable pour la production de vapeur: On se contente de gaz à 10 p. 100 de S2, la seconde phase de la fabrication nécessitant un nouvel apport d’oxygène. La formation de bioxyde d’azote néfaste pour certaines applications de l’acide sulfurique est évitée en ramenant la température de combustion à 800 0C.L’industrie de l’acide sulfurique était fondée en grande partie sur la pyrite (FeS2) dont la valeur économique varie suivant le lieu d’origine. La teneur en soufre des pyrites naturelles se situe entre 40 et 50 p. 100 (en théorie: 53,4 p. 100) en raison de la présence de cuivre, de plomb, de zinc, d’arsenic, de cobalt, etc. Certaines de ces impuretés sont valorisables (récupération des métaux nobles), d’autres gênantes (l’arsenic en particulier). Le grillage des pyrites peut se faire dans des fours rotatifs ou à soles étagées, mais leur emploi diminue constamment et ne présente plus qu’un intérêt historique. L’utilisation des pyrites reste importante en ex-U.R.S.S. et en Chine, mais décroît dans de nombreux pays pour des raisons de pollution. Certaines techniques effectuent le grillage éclair (flash roasting ): les poussières de pyrites sont injectées par le haut d’un réacteur chauffé à 1 000 0C et grillées en suspension à l’aide d’un courant d’air secondaire entrant par le bas. Les capacités unitaires de ces fours sont très élevées: 200 tonnes de pyrites par jour; la récupération de chaleur est bonne. À la différence de tous les autres fours de grillage, les résidus se composent non pas de Fe23, mais surtout de Fe34, conformément aux équations:
On se contente de gaz à 10 p. 100 de S2, la seconde phase de la fabrication nécessitant un nouvel apport d’oxygène. La formation de bioxyde d’azote néfaste pour certaines applications de l’acide sulfurique est évitée en ramenant la température de combustion à 800 0C.L’industrie de l’acide sulfurique était fondée en grande partie sur la pyrite (FeS2) dont la valeur économique varie suivant le lieu d’origine. La teneur en soufre des pyrites naturelles se situe entre 40 et 50 p. 100 (en théorie: 53,4 p. 100) en raison de la présence de cuivre, de plomb, de zinc, d’arsenic, de cobalt, etc. Certaines de ces impuretés sont valorisables (récupération des métaux nobles), d’autres gênantes (l’arsenic en particulier). Le grillage des pyrites peut se faire dans des fours rotatifs ou à soles étagées, mais leur emploi diminue constamment et ne présente plus qu’un intérêt historique. L’utilisation des pyrites reste importante en ex-U.R.S.S. et en Chine, mais décroît dans de nombreux pays pour des raisons de pollution. Certaines techniques effectuent le grillage éclair (flash roasting ): les poussières de pyrites sont injectées par le haut d’un réacteur chauffé à 1 000 0C et grillées en suspension à l’aide d’un courant d’air secondaire entrant par le bas. Les capacités unitaires de ces fours sont très élevées: 200 tonnes de pyrites par jour; la récupération de chaleur est bonne. À la différence de tous les autres fours de grillage, les résidus se composent non pas de Fe23, mais surtout de Fe34, conformément aux équations: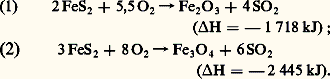 La présence de Fe34 est un avantage pour le traitement métallurgique des cendres, car celui-ci demande moins de charbon de réduction. Le procédé flash roasting fut mis au point pour l’utilisation des pyrites de flottation. Lorsque les pyrites ont une granulométrie supérieure à 0,1 mm, un broyage très coûteux s’avère nécessaire. C’est pourquoi le grillage dans des fours à lit fluidisé, selon la réaction (1), apparaît en définitive la solution la plus économique de grillage des minerais sulfurés. La dimension des grains peut alors atteindre 6 mm. L’air de combustion est soufflé de bas en haut à travers un lit de minerai à un débit tel qu’il se forme une suspension dense. À la sortie des fours, les gaz atteignent une concentration de 16 p. 100 en S2. Les installations traitent jusqu’à 500 tonnes par jour de pyrites; la teneur en soufre des cendres résiduaires est inférieure à 1,5 p. 100. Le seul inconvénient des fours à lit fluidisé vis-à-vis des fours traditionnels est de fournir des résidus contenant plus d’arsenic.La pyrrhotite, de composition approximative Fe7S8 (sulfure FeS contenant du soufre en solution solide), ne s’emploie que localement pour deux raisons: une plus faible teneur en soufre et un transport difficile (reprise en masse à l’air). Cependant, elle alimente avec succès l’important complexe de Safi, au Maroc. La combustion de la blende (ZnS) fournit aussi du gaz sulfureux; les fonderies de zinc sont toujours couplées avec une production d’acide sulfurique. En effet, pour la plupart des minerais, la fabrication de l’acide sulfurique est le processus secondaire; le but principal est l’obtention du métal. Lorsque le grillage a pour objet principal la préparation de S2, la combustion du soufre est préférée pour les unités de capacité inférieure à 20 t/j de S2. La récupération du gaz sulfureux à partir des minerais sulfurés de plomb et de cuivre a permis de résoudre des problèmes de rentabilité et de pollution.Une autre source d’anhydride sulfureux est constituée par le sulfate de calcium anhydre naturel (anhydrite) dont les vastes gisements, répandus dans le monde entier, sont aisément exploitables. Une partie du sulfate est réduite en sulfure en présence de charbon à 900 0C:
La présence de Fe34 est un avantage pour le traitement métallurgique des cendres, car celui-ci demande moins de charbon de réduction. Le procédé flash roasting fut mis au point pour l’utilisation des pyrites de flottation. Lorsque les pyrites ont une granulométrie supérieure à 0,1 mm, un broyage très coûteux s’avère nécessaire. C’est pourquoi le grillage dans des fours à lit fluidisé, selon la réaction (1), apparaît en définitive la solution la plus économique de grillage des minerais sulfurés. La dimension des grains peut alors atteindre 6 mm. L’air de combustion est soufflé de bas en haut à travers un lit de minerai à un débit tel qu’il se forme une suspension dense. À la sortie des fours, les gaz atteignent une concentration de 16 p. 100 en S2. Les installations traitent jusqu’à 500 tonnes par jour de pyrites; la teneur en soufre des cendres résiduaires est inférieure à 1,5 p. 100. Le seul inconvénient des fours à lit fluidisé vis-à-vis des fours traditionnels est de fournir des résidus contenant plus d’arsenic.La pyrrhotite, de composition approximative Fe7S8 (sulfure FeS contenant du soufre en solution solide), ne s’emploie que localement pour deux raisons: une plus faible teneur en soufre et un transport difficile (reprise en masse à l’air). Cependant, elle alimente avec succès l’important complexe de Safi, au Maroc. La combustion de la blende (ZnS) fournit aussi du gaz sulfureux; les fonderies de zinc sont toujours couplées avec une production d’acide sulfurique. En effet, pour la plupart des minerais, la fabrication de l’acide sulfurique est le processus secondaire; le but principal est l’obtention du métal. Lorsque le grillage a pour objet principal la préparation de S2, la combustion du soufre est préférée pour les unités de capacité inférieure à 20 t/j de S2. La récupération du gaz sulfureux à partir des minerais sulfurés de plomb et de cuivre a permis de résoudre des problèmes de rentabilité et de pollution.Une autre source d’anhydride sulfureux est constituée par le sulfate de calcium anhydre naturel (anhydrite) dont les vastes gisements, répandus dans le monde entier, sont aisément exploitables. Une partie du sulfate est réduite en sulfure en présence de charbon à 900 0C: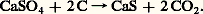 Le sulfure de calcium obtenu sert à réduire les trois quarts du sulfate restant, à 1 200 0C:
Le sulfure de calcium obtenu sert à réduire les trois quarts du sulfate restant, à 1 200 0C: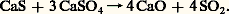 Des additions convenables d’argile et de sable permettent d’obtenir un « ciment Portland» de bonne qualité. Cette fabrication d’acide sulfurique associée à une production de ciment se compare favorablement sur le plan économique avec celle qui part du soufre. Le rendement en S2 correspond à peu près à 90 p. 100 de l’anhydrite mise en œuvre. Le sulfate de calcium naturel hydraté (le gypse: CaSO4, 2 H2O) est également concevable comme produit de départ, mais le coût de la déshydratation est élevé. Le recyclage du sulfate de calcium hydraté, sous-produit de la fabrication de l’acide phosphorique, fait l’objet d’études sérieuses.Parmi les autres sources d’anhydride sulfureux, on peut encore citer la combustion de l’hydrogène sulfuré issu des raffinages du pétrole ou des fours à coke; le grillage des pyrites de houille; le traitement des masses d’épuration des gaz de cokerie et du gaz à l’eau; la réduction du sulfate ferreux, sous-produit des ateliers de décapage et de la fabrication du blanc de titane.Le procédé aux oxydes d’azoteLa fabrication de l’acide sulfurique d’après l’équation:
Des additions convenables d’argile et de sable permettent d’obtenir un « ciment Portland» de bonne qualité. Cette fabrication d’acide sulfurique associée à une production de ciment se compare favorablement sur le plan économique avec celle qui part du soufre. Le rendement en S2 correspond à peu près à 90 p. 100 de l’anhydrite mise en œuvre. Le sulfate de calcium naturel hydraté (le gypse: CaSO4, 2 H2O) est également concevable comme produit de départ, mais le coût de la déshydratation est élevé. Le recyclage du sulfate de calcium hydraté, sous-produit de la fabrication de l’acide phosphorique, fait l’objet d’études sérieuses.Parmi les autres sources d’anhydride sulfureux, on peut encore citer la combustion de l’hydrogène sulfuré issu des raffinages du pétrole ou des fours à coke; le grillage des pyrites de houille; le traitement des masses d’épuration des gaz de cokerie et du gaz à l’eau; la réduction du sulfate ferreux, sous-produit des ateliers de décapage et de la fabrication du blanc de titane.Le procédé aux oxydes d’azoteLa fabrication de l’acide sulfurique d’après l’équation: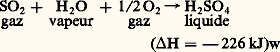 nécessite l’emploi de catalyseurs pour se dérouler à une vitesse satisfaisante industriellement. Les oxydes d’azote peuvent jouer ce rôle. De multiples théories ont été émises sur l’ensemble des mécanismes qui les font intervenir. Les réactions principales qui concourent à la formation de l’acide sulfurique semblent être les suivantes:
nécessite l’emploi de catalyseurs pour se dérouler à une vitesse satisfaisante industriellement. Les oxydes d’azote peuvent jouer ce rôle. De multiples théories ont été émises sur l’ensemble des mécanismes qui les font intervenir. Les réactions principales qui concourent à la formation de l’acide sulfurique semblent être les suivantes: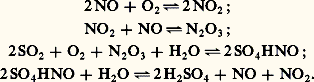 Le sulfate acide de nitrosyle S4HNO, pivot central de la préparation, régénère les oxydes d’azote par hydrolyse. En 1830, Louis Joseph Gay-Lussac montra qu’ils pouvaient être récupérés par absorption dans l’acide sulfurique. John Glover (1860) fit de la fabrication de l’acide sulfurique un processus cyclique, les réactions entre S2, 2, H2O et 23 ayant lieu dans des chambres de plomb. Julius Petersen (1905) a reconnu qu’un rendement élevé exigeait un mélange beaucoup plus intime des phases gazeuse et liquide que celui qui est réalisé dans les chambres. Les installations type Petersen (fig. 1) constituent la formule la plus moderne et la plus économique de catalyse par les oxydes d’azote. De même que, dans les systèmes de chambres, ces installations comportent, au début, une tour de dénitration (tour de Glover) et, à la sortie, deux tours d’extraction des oxydes d’azote (tours de Gay-Lussac). La tour de Glover doit refroidir les gaz de grillage de 400 0C à 100 0C environ, vaporiser complètement les vapeurs nitreuses de l’acide venant des tours de Gay-Lussac et concentrer cet acide. Il se forme déjà dans le glover une quantité importante d’acide sulfurique. Les chambres de plomb sont remplacées par des tours en fer dont l’intérieur est maçonné avec des briques antiacides. Un garnissage de silex augmente le contact entre les phases gazeuse et liquide. Le gain de place est considérable (90 p. 100 par rapport aux chambres). L’essentiel de l’oxydation est réalisé dans une première tour recevant une pulvérisation importante d’acide sulfurique, titrant 65 p. 100, qui hydrolyse le sulfate acide de nitrosyle. Les chaleurs de formation et de dilution de H2S4 sont évacuées à l’aide de serpentins réfrigérants. La deuxième tour qui convertit les dernières traces de S2 a principalement pour fonction de régulariser le système lorsqu’il est alimenté par des gaz dont la teneur en S2 est irrégulière. La troisième tour opère la régénération du mélange NO + 2 par oxydation de NO en 2 (fig. 2). La transformation du S2 est de 99 p. 100 environ. Les installations peuvent produire jusqu’à 600 t/j d’acide sulfurique à partir des gaz de grillage des pyrites dépoussiérées par cyclones et précipitateurs électrostatiques. La consommation en oxydes d’azote (perte par réduction en 2 et 2O, défaut d’absorption) est de 1 p. 100 de l’acide sulfurique produit. Elle est compensée par un apport d’acide nitrique. Si l’avenir appartient aux systèmes de tours pour le procédé aux oxydes d’azote, un grand nombre de chambres de plomb sont toujours en opération. Le procédé aux oxydes d’azote ne permet d’obtenir directement que des acides à 78 p. 100. Une concentration par chauffage conduit aux titres plus élevés. Les impuretés proviennent en général des matières premières (As, Se, composés nitreux) et des matériaux de construction des appareils (Pb, Fe).Le procédé de contactEn phase gazeuse homogène, l’oxydation de S2 en S3 se fait d’après la réaction réversible:
Le sulfate acide de nitrosyle S4HNO, pivot central de la préparation, régénère les oxydes d’azote par hydrolyse. En 1830, Louis Joseph Gay-Lussac montra qu’ils pouvaient être récupérés par absorption dans l’acide sulfurique. John Glover (1860) fit de la fabrication de l’acide sulfurique un processus cyclique, les réactions entre S2, 2, H2O et 23 ayant lieu dans des chambres de plomb. Julius Petersen (1905) a reconnu qu’un rendement élevé exigeait un mélange beaucoup plus intime des phases gazeuse et liquide que celui qui est réalisé dans les chambres. Les installations type Petersen (fig. 1) constituent la formule la plus moderne et la plus économique de catalyse par les oxydes d’azote. De même que, dans les systèmes de chambres, ces installations comportent, au début, une tour de dénitration (tour de Glover) et, à la sortie, deux tours d’extraction des oxydes d’azote (tours de Gay-Lussac). La tour de Glover doit refroidir les gaz de grillage de 400 0C à 100 0C environ, vaporiser complètement les vapeurs nitreuses de l’acide venant des tours de Gay-Lussac et concentrer cet acide. Il se forme déjà dans le glover une quantité importante d’acide sulfurique. Les chambres de plomb sont remplacées par des tours en fer dont l’intérieur est maçonné avec des briques antiacides. Un garnissage de silex augmente le contact entre les phases gazeuse et liquide. Le gain de place est considérable (90 p. 100 par rapport aux chambres). L’essentiel de l’oxydation est réalisé dans une première tour recevant une pulvérisation importante d’acide sulfurique, titrant 65 p. 100, qui hydrolyse le sulfate acide de nitrosyle. Les chaleurs de formation et de dilution de H2S4 sont évacuées à l’aide de serpentins réfrigérants. La deuxième tour qui convertit les dernières traces de S2 a principalement pour fonction de régulariser le système lorsqu’il est alimenté par des gaz dont la teneur en S2 est irrégulière. La troisième tour opère la régénération du mélange NO + 2 par oxydation de NO en 2 (fig. 2). La transformation du S2 est de 99 p. 100 environ. Les installations peuvent produire jusqu’à 600 t/j d’acide sulfurique à partir des gaz de grillage des pyrites dépoussiérées par cyclones et précipitateurs électrostatiques. La consommation en oxydes d’azote (perte par réduction en 2 et 2O, défaut d’absorption) est de 1 p. 100 de l’acide sulfurique produit. Elle est compensée par un apport d’acide nitrique. Si l’avenir appartient aux systèmes de tours pour le procédé aux oxydes d’azote, un grand nombre de chambres de plomb sont toujours en opération. Le procédé aux oxydes d’azote ne permet d’obtenir directement que des acides à 78 p. 100. Une concentration par chauffage conduit aux titres plus élevés. Les impuretés proviennent en général des matières premières (As, Se, composés nitreux) et des matériaux de construction des appareils (Pb, Fe).Le procédé de contactEn phase gazeuse homogène, l’oxydation de S2 en S3 se fait d’après la réaction réversible: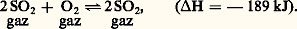 Le rendement en S3 est proportionnel à la racine carrée de la concentration en oxygène. L’exécution technique du procédé exige donc un large excédent en oxygène.Si l’emploi du platine comme catalyseur était connu depuis longtemps, les procédés dits de contact ne prirent leur essor industriel qu’après la Première Guerre mondiale lorsque la société B.A.S.F. breveta un catalyseur au vanadium très supérieur en durée de vie. Les réactions sont les suivantes:
Le rendement en S3 est proportionnel à la racine carrée de la concentration en oxygène. L’exécution technique du procédé exige donc un large excédent en oxygène.Si l’emploi du platine comme catalyseur était connu depuis longtemps, les procédés dits de contact ne prirent leur essor industriel qu’après la Première Guerre mondiale lorsque la société B.A.S.F. breveta un catalyseur au vanadium très supérieur en durée de vie. Les réactions sont les suivantes: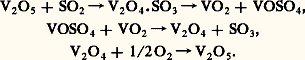 Outre son prix élevé, le platine initialement utilisé présentait l’inconvénient d’être sensible à l’empoisonnement par l’arsenic et les halogènes.Pour une composition des gaz (N2, 2, S2) de départ donnée, le taux de transformation de S2 en S3 diminue quand la température croît. L’élimination de la chaleur dégagée par la réaction s’impose donc, et il faut opérer entre 400 0C et 500 0C pour obtenir un taux de conversion suffisamment élevé. Malheureusement, les contacts au vanadium n’ont une efficacité suffisante qu’à température plus élevée. Pour limiter cet inconvénient, des catalyseurs mixtes associant de l’argent ou des alcalins au vanadium sont maintenant proposés. Ils sont précipités sur des substances à grande surface (gel de silice). Dans ce cas, la dissociation des combinaisons intermédiaires a lieu à température plus basse (450 0C). Si le rendement est favorable à 450 0C, la vitesse de réaction est lente; elle ne devient appréciable qu’à partir de 550 0C. Les procédés actuels de contact concilient ces exigences de température contradictoires de la manière suivante: les gaz passent d’abord sur une couche de catalyse à 575 0C avec une grande vitesse de réaction et un taux de conversion de 80 p. 100; ils sont ensuite refroidis à 450 0C avant de traverser les autres couches. Cette combinaison, qui opère la catalyse en deux temps, est d’une remarquable efficacité.Dans les installations modernes de contact (fig. 3), le soufre est souvent substitué aux pyrites en raison de sa facilité de mise en œuvre et de son abondance actuelle. Il est brûlé dans une chambre de combustion avec de l’air préalablement séché dans une colonne arrosée d’acide sulfurique à 95 p. 100. Les gaz sont refroidis dans une chaudière de récupération qui fournit de la vapeur comme sous-produit. Lorsque l’air utilisé est humide, la formation de brouillards d’acide par suite de l’oxydation partielle du soufre en S3 peut entraîner une corrosion de la chaudière. Les gaz dépoussiérés entrent alors dans un four à claies qui comporte quatre à cinq couches de catalyseurs. Lorsque les gaz passent d’une couche à l’autre, ils sont refroidis soit par passage dans un échangeur de chaleur destiné à produire de la vapeur, soit par injection d’air sec. À la sortie, l’anhydride sulfurique dilué contenu dans les gaz est absorbé dans une tour où ruisselle de l’acide sulfurique. Un système de circulation d’acide refroidit les colonnes de séchage et d’absorption. L’acide est recyclé en partie à la tour d’absorption et en partie à la tour de séchage. Le taux de conversion de S2 en S3 est compris entre 98 et 99 p. 100.Une absorption intermédiaire de l’anhydride sulfurique entre les troisième et quatrième couches de catalyse peut limiter la pollution atmosphérique par le gaz sulfureux non oxydé. En effet, l’équilibre gazeux d’oxydation est déplacé vers la droite lorsque la pression partielle d’anhydride sulfurique diminue dans le mélange réactionnel.Une telle installation de contact permet d’obtenir des acides sulfuriques de tout titre, des oléums et du S3 libre. Leur pureté est suffisante pour presque tous les emplois industriels. L’utilisation d’un gaz de grillage des pyrites nécessite une purification très poussée de S2, donc plus coûteuse; en particulier, le trioxyde d’arsenic colloïdal doit être éliminé. Cependant, les pyrites et les autres sources sulfureuses peuvent entrer en compétition avec le soufre dans certaines conditions économiques.Perspectives d’avenir des deux procédésLe procédé de contact qui conduit à un acide pur et concentré s’adapte mieux aux impératifs économiques du marché de l’acide sulfurique. Pour cette raison, la part de ce procédé augmente constamment dans tous les pays industriels. Le système aux oxydes d’azote ne représente plus que 20 p. 100 de la production de la France, et quelquefois moins ailleurs. Pourtant les transformations récentes, de type Petersen, ont renouvelé son intérêt. Il demeure économiquement valable lorsque la majeure partie de l’acide produit est destinée à la fabrication des engrais ou de certains produits chimiques de qualité courante pour lesquels la purification et la concentration ne s’imposent pas.
Outre son prix élevé, le platine initialement utilisé présentait l’inconvénient d’être sensible à l’empoisonnement par l’arsenic et les halogènes.Pour une composition des gaz (N2, 2, S2) de départ donnée, le taux de transformation de S2 en S3 diminue quand la température croît. L’élimination de la chaleur dégagée par la réaction s’impose donc, et il faut opérer entre 400 0C et 500 0C pour obtenir un taux de conversion suffisamment élevé. Malheureusement, les contacts au vanadium n’ont une efficacité suffisante qu’à température plus élevée. Pour limiter cet inconvénient, des catalyseurs mixtes associant de l’argent ou des alcalins au vanadium sont maintenant proposés. Ils sont précipités sur des substances à grande surface (gel de silice). Dans ce cas, la dissociation des combinaisons intermédiaires a lieu à température plus basse (450 0C). Si le rendement est favorable à 450 0C, la vitesse de réaction est lente; elle ne devient appréciable qu’à partir de 550 0C. Les procédés actuels de contact concilient ces exigences de température contradictoires de la manière suivante: les gaz passent d’abord sur une couche de catalyse à 575 0C avec une grande vitesse de réaction et un taux de conversion de 80 p. 100; ils sont ensuite refroidis à 450 0C avant de traverser les autres couches. Cette combinaison, qui opère la catalyse en deux temps, est d’une remarquable efficacité.Dans les installations modernes de contact (fig. 3), le soufre est souvent substitué aux pyrites en raison de sa facilité de mise en œuvre et de son abondance actuelle. Il est brûlé dans une chambre de combustion avec de l’air préalablement séché dans une colonne arrosée d’acide sulfurique à 95 p. 100. Les gaz sont refroidis dans une chaudière de récupération qui fournit de la vapeur comme sous-produit. Lorsque l’air utilisé est humide, la formation de brouillards d’acide par suite de l’oxydation partielle du soufre en S3 peut entraîner une corrosion de la chaudière. Les gaz dépoussiérés entrent alors dans un four à claies qui comporte quatre à cinq couches de catalyseurs. Lorsque les gaz passent d’une couche à l’autre, ils sont refroidis soit par passage dans un échangeur de chaleur destiné à produire de la vapeur, soit par injection d’air sec. À la sortie, l’anhydride sulfurique dilué contenu dans les gaz est absorbé dans une tour où ruisselle de l’acide sulfurique. Un système de circulation d’acide refroidit les colonnes de séchage et d’absorption. L’acide est recyclé en partie à la tour d’absorption et en partie à la tour de séchage. Le taux de conversion de S2 en S3 est compris entre 98 et 99 p. 100.Une absorption intermédiaire de l’anhydride sulfurique entre les troisième et quatrième couches de catalyse peut limiter la pollution atmosphérique par le gaz sulfureux non oxydé. En effet, l’équilibre gazeux d’oxydation est déplacé vers la droite lorsque la pression partielle d’anhydride sulfurique diminue dans le mélange réactionnel.Une telle installation de contact permet d’obtenir des acides sulfuriques de tout titre, des oléums et du S3 libre. Leur pureté est suffisante pour presque tous les emplois industriels. L’utilisation d’un gaz de grillage des pyrites nécessite une purification très poussée de S2, donc plus coûteuse; en particulier, le trioxyde d’arsenic colloïdal doit être éliminé. Cependant, les pyrites et les autres sources sulfureuses peuvent entrer en compétition avec le soufre dans certaines conditions économiques.Perspectives d’avenir des deux procédésLe procédé de contact qui conduit à un acide pur et concentré s’adapte mieux aux impératifs économiques du marché de l’acide sulfurique. Pour cette raison, la part de ce procédé augmente constamment dans tous les pays industriels. Le système aux oxydes d’azote ne représente plus que 20 p. 100 de la production de la France, et quelquefois moins ailleurs. Pourtant les transformations récentes, de type Petersen, ont renouvelé son intérêt. Il demeure économiquement valable lorsque la majeure partie de l’acide produit est destinée à la fabrication des engrais ou de certains produits chimiques de qualité courante pour lesquels la purification et la concentration ne s’imposent pas.
Encyclopédie Universelle. 2012.
